反应热计算
应用盖斯定律进行计算的方法
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
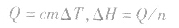
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
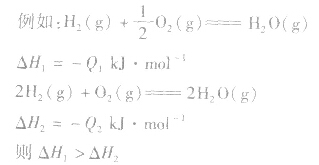
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即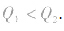
在298K、1.01×105Pa下,将22g CO2通入1mol·L-1 NaOH溶液750mL中充分反应,测得反应放出x kJ的热量。已知该条件下,1mol CO2通入2mol·L-1 NaOH溶液1L中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是 [ ] A.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) △H=-(8x-y)kJ·mol-1现已知:2H2(g)+O2(g)=2H2O(l),⊿H=-572kJ/mol;H-H键的键能为436kJ/mol;O=O键的键能为498kJ/mol,则H2O分子中O-H键的键能为 [ ]
A.485.5 kJ/mol
B.610 kJ/mol
C.917 kJ/mol
D.1220 kJ/mol一定条件下,充分燃烧一定量的丁烷放出热量161.9 kJ,经测定完全吸收生成的二氧化碳需消耗5mol/L的KOH溶液100mL,恰好生成正盐。则此条件下热化学方程式:  的ΔH为
的ΔH为 [ ]
A.+2590.4KJ/mol
B. -2590.4KJ/mol
C. +1295.2KJ/mol
D. -1295.2KJ/mol在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4mol液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64kJ的热量。
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+=N2H5++H2O
N2H4+H2O N2H5++OH-
N2H5++OH-
N2H5++H2O N2H62++OH-
N2H62++OH-
N2H5++H2O N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________。
A.肼水解显酸性
B.肼在水中可电离出H+离子
C.肼是二元弱碱
D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式_______________________。
(3)已知H2O(1)==H2O(g) △H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是___________________________。
(4)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是
_____________________。
(5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼,写出反应的化学方程式__________________________,该反应的还原产物是___________________。氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+O2(g)=H2O(l);△H=-285.8kJ/mol
CO(g)+ 1/2O2(g)=CO2(g);△H=-282.6kJ/mol
C8H18(l)+O2(g)=8CO2(g)+9H2O(l);△H=-5472kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-889.6kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是[ ] A.H2(g)
B.CO(g)
C.C8H18(l)
D.CH4(g)已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出XkJ热量。已知单质碳的燃烧热为YkJ/mol,则
1molC与O2反应生成CO的反应热△H为[ ] A.-YkJ/mol
B.(0.5Y-5X) kJ/mol
C.-(5X-0.5Y) kJ/mol
D.+(10X-Y) kJ/mol已知化学反应2C(s)+O2(g)=2CO(g),2CO(g)+ O2(g)=2CO2(g)都是放热反应。下列说法不正确的是 [ ] A.12gC(s)所具有的能量一定高于28gCO(g)所具有的能量
B.56gCO(g)和32gO2(g)所具有的总能量大于88gCO2(g)所具有的总能量
C.12gC(s)和32gO2(g)所具有的总能量大于44gCO2所具有的总能量
D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多已知在25℃  下,
下, 燃烧放出热量
燃烧放出热量 ;使1水的温度每升高1℃需热量近似为
;使1水的温度每升高1℃需热量近似为
(1)(标准状况)CO在25°、 下燃烧,释放出的热量是多少?
下燃烧,释放出的热量是多少?
(2)若热量损失20%,则上述CO燃烧时能使多少千克25℃的水沸腾?已知1mol CO气体完全燃烧生成CO2气体放出283 KJ热量;1mol H2完全燃烧生成液态水放出286 KJ热量;1mol CH4气体完全燃烧生成CO2气体和液态水放出890 KJ热量。
(1)若1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量__________890KJ。(填 “>”、“<” 或 “=”)
(2)若将nmol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,则放出热量(Q)的取值范围是 __________________________。
(3)若将amol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2气体和水的物质的量相等时,则放出热量(Q)的取值范围是 ____________________________。化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:
P-P 198kJ、 P-O 360 kJ、 O=O 498 kJ
已知:白磷(P4)和P4O6的分子结构如图所示。 白磷燃烧生成P4O6。
(1)白磷和P4O6中的化学键类型分别为________________和_________________
(2)1molP4燃烧生成P4O6时放出_____________kJ热量。以NA代表阿伏加德罗常数,则关于反应:C2H2(g)+2/5O2(g)=2CO2 (g )+H2O(l) △H=-1300kJ/mol热化学方程式的说法正确的是 [ ] A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量强酸与强碱的稀溶液发生中和反应的热效应,H+(aq) + OH-(aq) = H2O(液) △H=-57.3kJ/mol,向
1L0.5mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀硝酸,则恰好完全反应时的热效应△H、△H2、
△H3的关系正确的是[ ] A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H2>△H1>△H3
D.△H1>△H3>△H2已知CH4(g)+2O2(g)=2CO2(g)+2H2O(l);△H=-Q1kJ/mol,2H2(g)+O2(g)=2H2O(g) ;△H=-Q2 kJ/mol,
2H2(g)+O2(g)=2H2O(l) ;△H=-Q3 kJ/mol,常温下取体积比为4:1的CH4和H2的混合气11.2L(标况)经完全燃烧后恢复至常温,放出的热量是[ ] A.0.4Q1+0.05Q3
B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3
D.0.4Q1+0.2Q2在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g) + O2(g) = 2CO2(g);ΔH =-566kJ/mol
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l);ΔH =-890kJ/mol
由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为[ ] A.2912kJ
B.2953kJ
C.3236kJ
D.3867kJ已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为
-YkJ/mol,则C与1molO2反应生成CO时的反应热ΔH为[ ] A.-Y kJ/mol
B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol
D.+(10X-Y) kJ/mol火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为______________________
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ·mol-1。则16g液态肼与液态双氧水反应生成液态水时放出的热量是________________KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。某液化石油气由丙烷和丁烷组成,其质量分数分别为80%和20%,它们燃烧的热化学方程式分别为
C3H8(g)+5O2(g)→3CO2(g)+4H2O(g) △H=-2200KJ·mol-1
2C4H10(g)+13O2(g)→8CO2(g)+10H2O(g) △H=-5800KJ·mol-1
有一质量为0.8Kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗该液化石油气0.056Kg。试计算该燃料的利用率[已知水的比热为4.2KJ/(Kg·℃),铝的比热为0.88KJ/(Kg·℃) ]化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198KJ·mol-1.
P-O 360kJ·mol-1.氧气分子内氧原子间的键能为498kJ·mol-1则P4+3O2==P4O6的反应热△H为
[ ] A.+1638 kJ·mol-1
B.-1638 kJ·mol-1
C.-126 kJ·mol-1
D.+126 kJ·mol-1在36g 碳不完全燃烧所得气体中,CO占  体积,CO2占
体积,CO2占 体积,且
体积,且
C(s) + O2(g) =CO(g) △H=-110.5 kJ/mol;CO(g) +
O2(g) =CO(g) △H=-110.5 kJ/mol;CO(g) + O2(g) =CO2(g) △H =-283kJ/mol与这些碳完全燃烧相比,损失的热量是
O2(g) =CO2(g) △H =-283kJ/mol与这些碳完全燃烧相比,损失的热量是[ ] A.172.5 kJ
B.1149 kJ
C.283kJ
D.517.5 kJ已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0 kJ/mol 实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是[ ] A.1:3
B.3:1
C.1:4
D.1:1火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为______________________。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量
是_____________KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是__________________________硝化甘油(C3H5N3O9)分解时产物为N2、CO2、O2和液态水,它的分解反应的化学方程式是________________________。已知20℃时,22.7g硝化甘油分解放出的热量为154kJ,则每生成1mol气体伴随放出的热量为____________kJ。
已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220 kJ·mol-1
根据上面两个热化学方程式,试回答下列问题:
(1)H2的燃烧热为____________,C3H8的燃烧热为__________。
(2)1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(3)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的体积比是
______________。在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式______________________________________。
(2)已知H2O(l)== H2O(g) ΔH=+ 44kJ·mol-1,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
_______________________________________________。已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量;1mol氢气完全燃烧生成液态水放出286kJ热量;
1mol CH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。
(1)1molCH4气体完全燃烧生成气体CO2和水蒸气放出的热量______890kJ(填“<”、“ =” 或“>”)
(2)若将amol CH4、CO和H2的混合气体完全燃烧生成气体和液态水,则放出热量(Q)的取值范围
是__________________。
(3)若将amol CH4、CO和H2的混合气体完全燃烧生成气体和液态水,且二氧化碳和水的物质的量相等时,则放出热量(Q)的取值范围是________________________。已知2H2(g)+ O2(g)===2H2O(l) ΔH = -571.6 kJ· mol-1
CO(g) + 1/2O2(g) == CO2(g) △H = -283 kJ·mol-1 某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,求原混合气体中H2和CO的物质的量。强酸与强碱的稀溶液发生中和反应的热化学方程式为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1。向1L 0.5mol/LNaOH溶液中分别加入下列物质:
①稀醋酸:②浓硫酸;③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,其关系正确的是(注:弱电解质的电离是吸热过程)[ ] A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H3>△H2>△H1
D.△H1>△H3>△H2“西气东输”工程使东部发达地区的居民告别了管道煤气用上了天然气。已知某管道煤气的主要成分是
H2和CO,天然气的主要成分是CH4,它们燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(1);ΔH=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(1);ΔH=-890.31kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的可燃气体,理论上所获得的热量,后者大约是前者的多少倍[ ] A.1.3
B.1.6
C.3.1
D.0.8充分燃烧一定量的丁烷(C4H10)放出热量为Q,经测定完全吸收它生成的CO2需消耗5mol/LKOH溶液100mL,恰好生成正盐。则燃烧1mol丁烷放出的热量为 [ ] A.4Q
B.5Q
C.8Q
D.16Q已知碳酸钙分解的热化学方程式为CaCO3(s)=CaO(s)+CO2(g);△H=+178.5KJ·mol-1
(1)欲使2t CaCO3完全分解,最少需要提供多少热量?
(2)已知煤炭的热值为33KJ·g-1,请写出炭完全燃烧生成CO2时的热化学方程式,并计算若通过煤炭燃烧提供热量,则至少需要燃烧煤炭多少千克?已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1,-1411.0kJ·mol-1和
-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为[ ] A.-44.2kJ·mol-1
B.+44.2kJ·mol-1
C.-330kJ·mol-1
D.+330kJ·mol-1已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1,-1411.0kJ·mol-1和
-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为[ ]
A.-44.2kJ·mol-1
B.+44.2kJ·mol-1
C.-330kJ·mol-1
D.+330kJ·mol-1在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g) + O2(g) = 2CO2(g) △H = -566kJ/mol
CH4(g) + 2O2 (g) = CO2 (g) + 2H2O(l) △H = -890kJ/mol
由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为[ ] A.2912kJ
B.2953kJ
C.3236kJ
D.3867kJ已知:
2H2(g)+O2(g)==2H2O(l); △H =-571.6kJ/mol
2H2(g)+O2(g)==2H2O(g); △H =-483.6kJ/mol
CH4(g)+2O2(g)==2H2O(l)+CO2(g); △H =-890kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比__________________。下列说法或表示方法中正确的是 [ ] A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.已知C(s)+1/2O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s)
Z(g)+W(s)
ΔH>0。若平衡后加入X,则上述反应的ΔH增大
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -53.7kJ·mol-1,若将含0.5molH2SO4的浓溶液与含
1molNaOH的溶液混合,放出的热量大于53.7KJ已知使36g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:
C(s)+1/2O2(g)= CO(g) △H =-Q1kJ/mol
CO(g)+1/2O2(g)= CO2(g)△H =-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是中正确的是[ ] A.1/2Q2 kJ
B.Q2 kJ
C.1/3(Q1+Q2)kJ
D.1/3Q1 kJ已知H2(g)+Cl2(g)=2HCl(g) △H=―184.6kJ·mol-1,则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为 [ ] A.+184.6kJ·mol-1
B.―92.3kJ·mol-1
C.+92.3kJ
D.+92.3kJ·mol-1已知:
CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1=―Q1KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2= ―Q2KJ/mol
2H2(g)+O2(g)==2H2O(1) △H3= ―Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是[ ] A.放出的热量为(0.4Q1+0.05Q3)KJ/mol
B.放出的热量为(0.4Q1+0.05Q2)KJ/mol
C.△H2 > △H3
D.△H2 <△H3火箭推进器中盛有强还原性液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即生成大量氮气和水蒸气,并放出大量的热,已知0.4moL液态肼与过量的液态双氧水反应,生成氮气和水蒸气,放出256.65KJ的热量:
(1)该反应的热化学方程式为____________________
(2)又已知:H2O(g)→H2O(l) ;△H= -44KJ/moL,则16g液态肼与液态双氧水反应生成液态水时放出的热量是________________
(3)此反应应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_____________________不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的已知
H2O(g)=H2O(l); △H1=Q1kJ/mol
C2H5OH(g)=C2H5OH(l); △H2=Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g); △H3=Q3kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为[ ] A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3已知H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为 [ ] A.+184.6kJ·mol-1
B.-92.3kJ·mol-1
C.+92.3kJ
D.+92.3kJ·mol-1在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式 ______________________________。
(2)已知H2O(l)== H2O(g) ΔH =+ 44 kJ·mol-1,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是______________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
____________________。一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100g
CaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是[ ] A.0.5Q
B.Q
C.2Q
D.5Q使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+ 1/2O2(g)=CO(g)
△H=-Q1kJ/mol ; CO(g)+1/2O2(g)=CO2(g) △H=-Q2kJ/mol 与这些焦炭完全燃烧相比较,损失的热量是[ ] A.1/3Q1 kJ
B.1/3Q2 kJ
C.1/3(Q1+Q2) kJ
D.1/2Q2 kJ已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890kJ·mol-1 现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ。则原混合气体中H2与CH4的物质的量之比是[ ] A.1︰1
B.1︰3
C.1︰4
D.2︰3在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积。且有:
C(s)+1/2O2(g)=CO(g) △H=-110.5kJ/mol,CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是[ ] A.172.5kJ
B.1149kJ
C.283kJ
D.517.5kJ火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8molH2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃.101 kPa下测得的热量)。
(1)反应的热化学方程式为_______________________。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是_____________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是__________________________。已知H2(g)+Cl2(g)=2HCl(g) △H=―184.6kJ·mol-1, 则反应HCl(g)=H2(g)+Cl2(g)的△H为 [ ] A.+184.6kJ·mol-1
B.―92.3kJ·mol-1
C.―369.2kJ·mol-1
D.+92.3kJ·mol-1氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是[ ] A.H2(g)
B.CO(g)
C.C8H18(l)
D.CH4(g)
- 1一位旅游者去过吐鲁番、漠河、五道梁、海口后,总结出一句话是[ ]A、冬季寒冷 B、降水量丰富 C、季风显著
- 2等腰三角形的一边长是3cm,周长是12cm,则腰长是______cm.
- 3一般地,如果函数的定义域为,值域也是,则称函数为“保域函数”,下列函数中是“保域函数”的有_____________.(
- 4等物质的量的下列有机物完全燃烧时,耗氧量最大的是( )A.乙烯B.甲烷C.乙炔(C2H2)D.苯(C6H6)
- 5已知,A为空气中含量最多的单质。根据下图转化关系,回答下列问题:(1)写出下列物质的化学式:A 、D
- 62012年9月10日,人民日报发表《中华人民共和国政府关于----及其附属岛屿的领海基线的声明》,宣布中华人民共和国钓鱼
- 7读下列图文材料,完成相关问题。(12分)材料一:我国西部大开发重点产业地带空间分布图材料二:上图圆内部分为2009年全国
- 8下列各句中,没有语病的一句是( )A.清明假期期间,上海泗泾塘、洞泾港部分水域发现大量死鱼漂浮。目前,松江公布初步调查
- 9如图所示,一只上口小、下底大的平底容器装满纯净水放在水平桌面上,容器质量为m,水的质量为M.用F1表示水对容器底面的压力
- 10已知A、B、C三点的坐标分别为A(3,0),B(0,3),C(cosα,sinα),α∈(,)。(1)若,求角α的值;(
- 1某人因外伤出血,血色暗红,血流较缓,紧急的抢救措施是A.赶紧送往医院B.指压法远心端压住C.消毒后用纱布包扎D.止血带近
- 2直线l:x-2y+m=0按向量=(2,﹣3)平移后得到的直线l1与圆(x﹣2)2+(y+1)2=5相切,则m的值为[
- 3设函数,证明:(Ⅰ)对每个,存在唯一的,满足;(Ⅱ)对任意,由(Ⅰ)中构成的数列满足.
- 4(8分):学生的平时作业、期中考试、期末考试三项成绩分别按2:3:5的比例计入学期总评成绩。小明、小亮、小红的平时作业、
- 5欧洲文艺复兴运动的实质是( )A.古希腊、罗马文化的复兴B.封建文化的复兴C.资产阶级文化的兴起D.现代文化的兴起
- 6下列各句中,没有语病的一句是( )A.的确,我们很难简单地概括出中国文学的传统,但大约不会有人否认,先秦文学的《诗经》、
- 7中国第一块奥运会金牌获得者—— 。
- 82011年10月15日至18日,中国共产党第十七届中央委员会第六次全体会议在北京举行。会议审议通过《中共中央关于深化
- 9某有机物燃烧后产物只有CO2和H2O,可推出的结论是,这种有机物中[ ]A.一定只有C、HB.可能含有C、H、O
- 10电线杆在阳光照射下的影长为7米,1根长1米的直立细杆的影长是1.2米,求电线杆的高是多少?






