百科
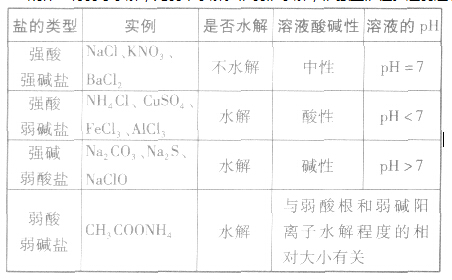
盐类水解的原理
定义
在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
实质
生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
条件
盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
特点
可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
规律
有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时
相关试题
下列过程或现象与盐类水解无关的是 [ ] A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀
D.浓的硫化钠溶液有臭味下列各反应离子方程式中,属于水解反应的是 [ ] A.HCO3-+H2O  H3O++CO32-
H3O++CO32-
B.HS-+H2O H2S+OH-
H2S+OH-
C.H2PO4-+H2O HPO42-+H3O+
HPO42-+H3O+
D.HCO3-+OH- H2O+CO32-
H2O+CO32-25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是 [ ] A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大下列关于盐类水解的叙述中,错误的是 [ ] A.盐类水解是中和反应的逆反应
B.盐类水解过程是吸热过程
C.含有弱酸根盐的水溶液一定显碱性
D.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是 [ ] A.CaO2的水解产物是Ca(OH)2和H2O2
B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO
D.Mg3N2的水解产物是两种碱性物质下面提到的问题中,与盐的水解无关的正确说法是 [ ] ①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气
⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性
A.①④⑦
B.②⑤⑧
C.③⑥⑨
D.全有关盐的水解程度大小可以用“水解度”来表示。关于NaA(A-表示一元酸根离子)型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数。若测得2 L1 mol·L-1的强碱弱酸盐NaA溶液pH为10,则A-离子的水解度是 [ ] A.0.01%
B.0.1%
C.0.2%
D.1%下列过程或现象与盐类水解无关的是 [ ] A.硫酸铝溶液不能放在铁质容器中
B.实验室用锌粒和稀硫酸制氢气加入少量硫酸铜溶液加快实验室制氢气的速率
C.用热的纯碱溶液去除油污
D.浓硫化钠溶液有硫化氢的气味下列有关问题,与盐的水解有关的是 [ ] ①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③
B.②③④
C.①④⑤
D.①②③④⑤在25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断正确的是 [ ] A.c(OH-)前者大于后者
B.均存在电离平衡和水解平衡
C.存在的粒子种类相同
D.溶液中阳离子浓度相同化学与生产、生活密切相关,下列可用盐类水解原理解释的是 [ ] A. 被蚊虫叮咬后用稀氨水涂抹可止痒
B. 自来水厂常将氯气通入水中***菌消毒
C. 误食可溶性钡盐应尽快用5.0%的硫酸钠溶液洗胃
D. 农业生产中铵态氮肥不能和草木灰混合施用下列事实不属于盐类水解应用的是 [ ] A.明矾、氯化铁晶体常用于净水
B.实验室通常使用热的纯碱溶液去除油污
C.实验室配制FeCl3溶液时加入少量稀盐酸
D.实验室制氢气时加入CuSO4可加快反应速率广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然 后两两重新组合成新的物质。根据上述观点,下列说法不正确的是 [ ] A.CaO2的水解产物是Ca(OH)2和H2O2
B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO
D.Mg3N2水解生成NH3和Mg(OH)2为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥:
①K2CO3、②KCl、③Ca(H2PO4)2、 ④(NH4)2SO4、⑤氨水,最适合的组合是[ ] A.①③④
B.②③④
C.①③⑤
D.②③⑤下列有关问题与盐的水解有关的是 [ ] ①NH4Cl与ZnCl2溶液可用作焊接金属时的除锈剂
②NaHCO3与Al2 (SO4)3两种溶液可作泡沫灭火剂
③某CH3COOH和CH3COONa的混合溶液中c(Na+) =c(CH3COO-)
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
A.①②③
B.②③④
C.①④
D.①②③④下列根据反应原理设计的应用,不正确的是 [ ] A.CO32-+H2O  HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
D.SnCl2+H2O Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着________个平衡体系,用电离方程式或离子方程式表示:(可填满,也可不填满,如不够空,可以再加)a.____________b.____________c.____________
(2)溶液中共有_______种不同的粒子
(3)在这些粒子中,浓度为0.01mol/L的是____________,浓度为0.002mol/L的是____________;
(4)__________和__________两种粒子物质的量之和等于0.01mol。下列应用中与盐类水解无关的是 [ ] A.明矾净水
B.实验室配制FeCl3溶液时加入少量稀盐酸
C.使用热的纯碱溶液去除油污
D.实验室制H2时加入CuSO4可提高反应速率在一定条件下发生下列反应,其中属于盐类水解反应的是 [ ] A.NH4++2H2O  NH3·H2O+H3O+
NH3·H2O+H3O+
B.HCO3-+ H2O H3O+ + CO32-
H3O+ + CO32-
C.HS-+H+=== H2S
D.Cl2+H2O H++Cl-+HClO
H++Cl-+HClO 250C时,将0.005mol的CH3COONa和0.001molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在3个平衡体系,用电离方程式或离子方程式表示______________。
(2)溶液里共有__________种不同的粒子(指分子或离子)。
(3)在这些粒子中,浓度为0.005mol/L的是________,浓度为0.001mol/L的是__________。
(4)_________和_________两种粒子的物质的量之和等于0.005mol。
(5)__________和__________两种粒子的物质的量之和比氢离子数量多0.004mol。(1)碳酸钾溶液蒸干灼烧得到的固体物质是 ____,原因____。
(2) KAl(SO4)2溶液蒸干得到的固体物质是___,原因是____。
(3)碳酸氢钡溶液蒸干得到的固体物质是___,原因是____。
(4)亚硫酸钠溶液蒸干得到的固体物质是___,原因是____。
(5)氯化铝溶液蒸干灼烧得到的固体物质是___,原因是____。25℃时,将0.01 molCH3COONa和0.002 mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示: ①____; ②_____; ③____。
(2)溶液中共有___种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是____,浓度为0. 002 mol·L-1的是____。
(4)____和___两种粒子物质的量之和等于0.01 mol。下列根据反应原理设计的应用,不正确的是 [ ] A.CO32-+H2O  HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl 制备TiO2纳米粉
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D.SnCl2+H2O Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 下列过程或现象与盐类水解无关的是 [ ] A. 热的纯碱液用于去油污
B. 加热氯化铁溶液颜色变深
C. 饱和食盐水使甲基橙显黄色
D. 泡沫灭火器中的Al2(SO4)3溶液不能装在铁筒里广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是水解物质和水分别解离成两部分,然后两两重新结合成新的物质。据此信息,下列说法不正确的是 [ ] A.CaO2的水解产物是Ca(OH)2和H2O2
B.PCl3的水解产物是HClO和PH3
C.CaC2的水解产物之一是C2H2
D.Mg3N2的水解产物是Mg(OH)2和NH3下列实验操作或对实验事实的描述正确的是
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
②配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末。
④实验室用铜片与稀硝酸反应产生的气体可用排水法收集。
⑤试管中加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现。
⑥向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同。
⑦苯与溴水在铁粉的催化作用下制备溴苯。
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多。[ ] A. ①②④⑥
B. ①③④⑤⑥
C. ③④⑥⑦
D. ③⑦⑧下列根据反应原理设计的应用,不正确的是 [ ] A.CO32-+H2O  HCO3-+OH- 用热的纯碱溶液清洗油污
HCO3-+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl 制备TiO2纳米粉
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D.SnCl2+H2O Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I.属于非电解质的是______;(填序号)
Ⅱ.(1)NaHCO3是一种______(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:______;
(3)常温下,0.1mol-L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH -五种微粒的浓度由大到小的顺序为:______.
Ⅲ.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
(1)该Ba(OH)2溶液的物质的量浓度为______;
(2)溶液中由水电离出c(OH -)=______;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=______.
Ⅳ.醋酸是一种弱电解质. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.则图______(填“I”或“Ⅱ”)为醋酸稀释的图象.
相同物质的量浓度的NaCN和NaClO溶液相比,前者的pH较大,则下列有关同温、同体积和同浓度的HCN和HClO叙述中,正确的是( ) A.酸性:HCN>HClO B.pH:HClO>HCN C.浓度:c(CN-)<c(ClO-) D.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN 广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述信息,下列说法不正确的是( ) A.CaO2的水解产物是Ca(OH)2和H2O2 B.PCl3的水解产物是HClO和PH3 C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱性物质 将少量碳酸镁粉末加入水中,通入足量的CO2气体后,粉末完全溶解,生成了碳酸氢镁,再加热,溶液又变浑浊,生成氢氧化镁沉淀和CO2气体.上述转化过程中,没有发生的平衡移动是( ) A.溶解平衡 B.电离平衡 C.水解反应化学平衡 D.氧化还原反应化学平衡 下列物质中,能发生水解反应的是( ) A.苯 B.乙酸 C.淀粉 D.葡萄糖 下列说法正确的是( ) A.溶液的pH值越小,其中含有的氢离子就越多 B.物质的水溶液浓度越高,密度越大 C.单质的化学活动性越强,氧化性也越强 D.相同条件时,酸性越弱的酸,其对应的钠盐的水溶液碱性越强 下列溶液在常温下显酸性的是( ) A.NaOH B.Na2CO3 C.NH4Cl D.NaCl 广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质.根据上述观点,下列说法错误的是( ) A.CaO2的水解产物是Ca(OH)2和H2O2 B.(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br C.PCl3的水解产物是PH3和HClO D.A1(C2H5)3的水解产物是Al(OH)3与C2H6 下列物质的水溶液,其pH小于7的是( ) A.Na2CO3 B.NH4NO3 C.Ba(OH)2 D.KNO3
最新试题
- 1痰主要由( )等组成的,所以不要随地吐痰.A.唾液、溶菌酶B.黏液、细菌、灰尘C.病菌、二氧化碳D.灰尘、溶菌酶
- 2下列说法正确的是A.石油的分馏和煤的干馏均为化学变化B.2,3一二甲基丁烷的核磁共振氢谱中会出现两个峰C.汽油和植物油的
- 3由某物质R和Na2SO4组成的固体混合物放入足量水中,充分搅拌,过滤后得到白色沉淀11.65g,经试验,该白色沉淀不溶于
- 4My advisor encouraged ____ a summer course to improve my wri
- 5奥斯特瓦尔德是德国著名的化学家。有一天,由于牙病发作,疼痛难忍,他的情绪很坏。他走到书桌前,拿起一位不知名的青年寄来的稿
- 6是否存在这样的整数a,使方程组的解是一对非负数?如果存在,求出它的解,若不存在,请说明理由。
- 7下列关于力的合成和分解的说法,正确的是 ( )A.两个力的合力,可能比这两个分力都小B.已知合力及一个分力的大小和
- 8中国的首艘航空母舰、经过改装的“瓦良格”号在进行了一系列海试后,已于2012年9月25日正式列装服役,更名为“辽宁舰”。
- 9(8分)下图表示生态系统中各成分之间的关系,请据图回答:(1)图中植物属于生态系统中的 (成分),
- 10(8分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有
热门考点
- 1将质量为m的滑块放在倾角为θ的固定斜面上.滑块与斜面之间的动摩擦因数为μ.若滑块与斜面之间的最大静摩擦力与滑动摩擦力大小
- 2在“把电流表改装为电压表”的实验中,测电流表G 的内阻时备有下列器材:A.待测电流表(量程lmA ,内阻约几十欧)B.滑
- 3根据下列装置图回答问题。①写出图中标有小写字母的仪器的名称:a b 。②若
- 4下列各组数中,互为相反数的是A.2和B.-2和-C.-2和︱-2︱ D.和
- 5金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是 ( )①密度较
- 6《红楼梦》第一百十五回 《红楼梦》中甄宝玉和贾宝玉异同点?曹雪芹刻画出这样一个人物的真实用意何在?
- 7 “苟利国家生死以,岂因祸福避趋之?”民族英雄林则徐的这一诗句,不仅激励了几代中国人抗击外国侵略,维护民族利益的斗争精神
- 8下列语句中,划线的成语使用恰当的一项是( )A.这些食品是交给姐姐保管的,可她并不是一个从长计议的人,常常领着我们将下
- 9— Mary, could you please lend me your bike? — Sure, __
- 10等于( )A.B.C.D.

 溶液时加入少量稀盐酸
溶液时加入少量稀盐酸 可加快反应速率
可加快反应速率