百科
溶液的酸碱性与pH
内容
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
溶液酸碱性判断
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)
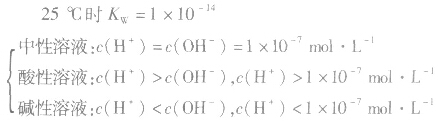
关于pH相同的酸
关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH定义
溶液里H+的物质的量浓度的负对数叫做pH。
表达式

溶液的pH概念
含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液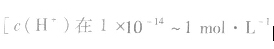 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
溶液的酸碱性和pH:
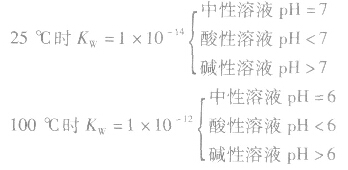
相关试题
在室温下,等体积的酸和碱的溶液,混合后pH一定小于7的是 [ ] A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的硫酸跟pH=11的氢氧化钾溶液
D.pH=3的醋酸跟pH=11的氢氧化钡溶液某温度下,水的离子积常数Kw=10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为 [ ] A.1:10
B.9:1
C.10:1
D.99:21A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是_______________
(a)A、B、E不可能在同一主族
(b)A、B、C可能在同一周期
(c)C的最高价氧化物的水化物可能显碱性
(d)C和D的单质可能生成离子化合物
(2)若A与D同主族,B是形成化合物种类最多的元素,C原子的最外层电子数比A与B的最外层电子总数还多1。则A与C元素按原子个数比1:1形成的化合物F的电子式为___________;C与D形成的原子个数比为1:1的化合物19.5g与足量的水反应时,转移电子的物质的量为____________mol;
(3)由ABCD四元素形成的无机化合物水溶液呈___________性(填酸或碱),其原因用离子反应方程式为______________________。在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是 [ ] A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钡溶液pH是描述溶液酸碱性的一个重要指标,下列说法不正确的是 [ ] A.正常情况下,人体血液的pH总保持在弱碱性范围
B.正常雨水偏酸性,pH约为5.6
C.测定某溶液的pH时,应先用蒸馏水润湿pH试纸
D.pH为1的溶液肯定能够导电常温下,有pH=12的NaOH溶液10ml;要使它的pH降为11。
(1)若加入蒸馏水,则加入蒸馏水的体积为___________ml。
(2)若加入pH=3的HCl溶液,则加入HCl溶液的体积为____________ml。在常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(忽略溶液体积变化),则对反应后溶液的叙述正确的是 [ ] A.c(A-)<c(K+)
B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V后≥20mL
D.V后≤20mL取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为 [ ] A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是 [ ]
A.加入的碱过量
B.生成的盐发生水解
C.反应后溶液中c(A-)= c(M+)
D.混合前酸与碱中溶质的物质的量相等强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为 [ ]
A.1 : 1
B.2 : 1
C.1 : 10
D.10 : 1有pH=12的NaOH溶液100mL,要使溶液pH降为11,需分别加入:
(1)蒸馏水_______毫升;
(2)pH=3的HCl溶液_______毫升。下列叙述正确的是 [ ]
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液加水稀释10倍后pH=4
C.0.2mol/L的盐酸与等体积水混合后,溶液的pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后溶液的pH=7下列叙述正确的是 [ ] A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.由强酸、强碱等物质的量反应得到的溶液pH=7下列说法中正确的是 [ ] A.在25℃纯水中,c(H+)=c(OH-)=10-7 mol/L,呈中性
B.溶液中,若c(H+) > 10-7mol/L,则c(H+) > c(OH-),呈酸性
C.c(H+)越大,则pH越大,溶液的碱性越强
D.pH=0的溶液中,只有H+而无OH-对于溶液的酸碱性说法正确的是 [ ] A.由强酸.强碱等物质的量反应制得的溶液中性
B.pH等于7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性
D.不能使酚酞试液变红的溶液一定呈酸性常温下某强酸溶液pH=b,某强碱溶液的pH=a,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液的体积V酸和碱溶液的体积V碱的正确关系是 [ ] A.V碱 = 102V酸
B.V酸 = 102V碱
C.V酸 = 2V碱
D.V酸 = V碱有一种pH为12的NaOH溶液100mL,要使它的pH降到11,
(1)如果加入蒸馏水,应加________mL。(溶液总体积允许相加。下同)
(2)如果加入pH=l0的NaOH溶液,应加_______mL。
(3)如果加入0.0l mol·L-1的盐酸,应加_______mL。常温下,强酸溶液A和强碱溶液B的pH之和为16,当它们按一定体积比混合时,溶液的pH恰好等于7,则A与B的体积比是 [ ]
A.1︰10
B.10︰1
C.1︰100
D.100︰1在室温下,下列叙述正确的是 [ ] A.将1mL 1.0×10-5mol/L盐酸稀释到1000mL,得到pH=8的盐酸
B.将1mL pH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸
C.用pH=1的盐酸分别中和1mL pH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-)与PH类似,我们定义POH=-lgc(OH-),下列溶液,一定呈中性的是 [ ] A.c(H+)=1×10-7mol·L-1的溶液
B.水电离的H+和OH-浓度相等的溶液
C.PH+POH=14的溶液
D.PH=POH的溶液下列溶液一定呈中性的是 [ ]
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液某温度下,水的离子积常数Kw=10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为 [ ] A.1︰10
B.9︰1
C.10︰1
D.99︰21常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是________ 下列说法正确的是 [ ] A.t°C时,某溶液的PH=6,则该溶液一定为酸性
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
D.甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰已知298K时,Mg(OH)2的溶度积常数Ksp=4.0×10-12,向c(Mg2+)=1mol·L-1的MgCl2溶液中滴加NaOH调节
pH,则开始出现白色沉淀时溶液的pH(精确到整数)约为(lg2=0.301)[ ] A.8
B.9
C.10
D.11(1)在温度t℃时,某溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则t______25(填“大于”、“小于”或“等于”)。
(2)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示
x = _____。Ba(OH)2溶液的物质的量浓度为_______________。
(3)常温下,向100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH_____________7(填“大于”、“小于”或“等于”);原混合溶液中硫酸钠的物质的量浓度为___________________。取浓度相同的NaOH 和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 [ ] A.0.01mol·L-1
B.0.017mol·L-1
C.0.05mol·L-1
D.0.50mol·L-1(1)在25℃时,有pH=a的盐酸和pH=b的苛性钠溶液,现取VamL盐酸用该苛性钠溶液VbmL刚好中和。若a+b=13,则Va/Vb=____________。
(2)将pH=3的弱酸溶液稀释100倍,该溶液的pH范围为:__________ 。常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。 现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是 [ ] A.加入10mL 0.01mol/L的NaOH溶液
B.加入10mL 的水进行稀释
C.加水稀释成100mL
D.加入10mL 0.01mol/L的盐酸溶液(1)取体积相同(25mL)的两份0.10mol·L-1NaOH溶液,将其中一份放在空气中一段时间后,溶液的PH
_______(填“增大”、“减小”或“不变”),其原因是______________________。
(2)用已知浓度的盐酸中和上述两份溶液,若中和放置空气中一段时的那份消耗盐酸的体积为VA,另一份消耗盐酸的体积为VB,则
①以甲基橙为指示剂时,VA与VB的关系是__________________。
②以酚酞为指示剂时,VA和VB的关系是___________________。25℃时,若体积为Va、PH=a的某一元强酸与体积为Vb、PH=b的某一元强碱混合,恰好中和,且已知
Va<Vb和a=0.5b。请填写下列空白
(1)a值可否等于3(填“可”或“否”)______,其理由是________________________。
(2)a值可否等于5(填“可”或“否”)______,其理由是________________________。
(3)a的取值范围是__________________。室温时,下列溶液混合后,pH大于7的是 [ ] A.0.1mol/L的盐酸和pH=13的氢氧化钡溶液等体积混合
B.0.1mol/L的NaHCO3溶液和pH=1的盐酸等体积混合
C.pH=3的硫酸和pH=11的氨水等体积混合
D.pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合下列说法正确的是 [ ] A.酸式盐的水溶液一定显碱性
B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子的物质的量浓度和OH-离子的物质的量浓度相等
D.NaHCO3溶液的PH大于Na2SO4溶液的PH水是最宝贵的资源之一。下列表述正确的是 [ ] A.H2O的电子式为 
B.4℃时,纯水的pH=7
C. 中,质量数之和是质子数之和的两倍
中,质量数之和是质子数之和的两倍
D.273K、101kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)下列判断正确的是 [ ] A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH
D.1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L mol·L-1硫化钠溶液吸收SO2的量室温时,下列混合溶液的pH一定小于7的是 [ ] A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能 [ ] A.生成一种强酸弱碱盐
B.弱酸溶液和强碱溶液
C.强酸与弱碱溶液反应
D.一元强酸溶液与一元强碱溶液反应常温下,现有pH=3的某酸HX溶液和pH=11某碱YOH溶液,两溶液混合后,溶液的pH小于7。下表中判断合理的是 [ ]


 的溶液
的溶液 的溶液
的溶液  之比为
之比为