乙醛的性质
物理性质
乙醛是无色、有刺激性气味的液体,密度小于水,沸点为20.8℃。乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。冈为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
化学性质
乙醛分子中的醛基(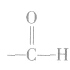 )对乙醛的主要化学性质起决定作用。
)对乙醛的主要化学性质起决定作用。
(1)加成反应
乙醛分子中醛基上的碳氧双键与碳碳双键相似,能够发生加成反应。如使乙醛蒸气和氢气的混合气体通过热的催化剂,乙醛与氢气即发生加成反应:
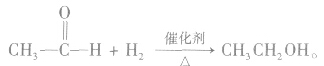
说明:a.乙醛的催化加氢反应也是还原反应。
b.常见的能发生加成反应的官能团(或基团)有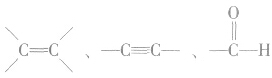 等,但它们发生加成反应的条件不同。
等,但它们发生加成反应的条件不同。
c.由乙醇的催化氧化反应和乙醛的催化加氢反应可知,乙醇和乙醛可在一定条件下相互转化: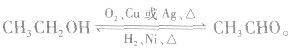
(2)氧化反应
①与银氨溶液的反应——银镜反应
Ag(NH3)2OH(氢氧化二氨合银)是一种弱氧化剂,能把乙醛氧化成乙酸,乙酸又与氨反应生成乙酸铵,而Ag+被还原成金属银附着在试管壁上,形成银镜,所以,这个反应叫做银镜反应。银镜反应常用来检验醛基的存在。工业上可利用这一反应原理,把银均匀地镀在玻璃上制成镜子或保温瓶胆(生产上常用含有醛基的葡萄糖作为还原剂)。
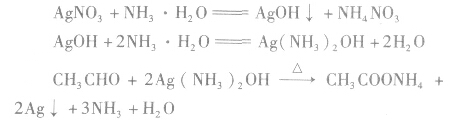
注意a.实验所用试管(玻璃)要洁净。
b.银氨溶液要新配制的,配制银氨溶液是向 AgNO3稀溶液中逐滴加入稀氨水,直到最初生成的沉淀恰好溶解为止。要防止氨水过量,并且必须随配随用,不可久置,否则会生成容易爆炸的物质。
c.实验条件是水浴加热,不能直接加热煮沸。
②与新制氢氧化铜的反应在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4~6滴,得到新制的氢氧化铜,振荡后加入乙醛溶液0.5mL,加热煮沸。观察并记录实验现象。
实验现象:生成红色沉淀。
实验结论:在加热的条件下,乙醛能与新制的氢氧化铜发生化学反应。
乙醛与新制的氢氧化铜反应的实验中,涉及的主要化学反应是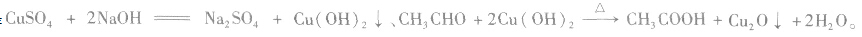 反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
乙醛与新制的氢氧化铜的反应原理,可用于在实验室里检验醛基的存在,在医疗上检验尿糖。
说明:a.制备新制的Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶液,应保持碱过量;
b.反应条件必须是加热到沸腾。
③与氧气的反应乙醛如在一定温度和催化剂存在的条件下,也能被空气中的氧气氧化成乙酸:

在点燃的条件下,乙醛能在空气或氧气中燃烧。 乙醛完全燃烧的化学方程式为:
注意a.在工业上,可以利用乙醛的催化氧化反应制取乙酸。
b.银氨溶液、新制氢氧化铜的氧化性很弱,乙醛能被这样的弱氧化剂氧化,原因是乙醛的还原性很强。由此推理,乙醛也易被酸性高锰酸钾溶液、溴水等氧化,高锰酸钾、溴被还原而使溶液褪色。
某课外活动小组利用下图装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白 
(1)甲装置常常浸在70~80℃的水浴中,目的是______________。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为____________________________。
②控制鼓气速度的方法是控制甲中单位时间内的气泡数,若鼓气速度过快,则会__________________,若鼓气速度过慢则会反应放热太少,不能达到反应所需温度。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_________、_______接丙。
(4)简述如何验证丁装置中乙醛的存在。
_____________________________________________________________下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 
[ ] a b c A. Al AlCl3 Al(OH)3 B. HNO3 NO NO2 C. Si SiO2 H2SiO3 D. CH2=CH2 CH3CH2OH CH3CHO 实验室做乙醛和银氨溶液反应的实验:
(1)为产生光亮的银镜,试管应先用____溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净。
(2)配制银氨溶液时向盛有____溶液的试管中逐滴滴加____,边滴边振荡,直到____为止。有关反应的离子方程式为:①____;②____。
(3)加热时应用____加热,产生银镜的离子方程式为:____。写出下列反应的化学方程式: (1)实验室制乙炔_______________。
(2)TNT炸药制取 。
(3)苯酚和溴水反应_______________。
(4)乙醛与新制Cu(OH)2反应_____________。
(5)溴乙烷消去反应 。有几种物质:①苯、②邻二甲苯、③聚乙烯、④聚1,3-丁二烯、⑤2-丁炔、⑥环己烷、⑦乙醛,既能使酸性高锰酸钾溶液褪色,又能使溴水因化学反应而褪色的是 [ ] A. ④⑤⑦
B. ③④⑤⑥
C. ①②④⑤
D. ③④⑤⑦某学生做乙醛还原的实验,取1mol/L的硫酸铜溶液2mL和0.4mol/L的氢氧化钠溶液4mL,在一个试管里混合加入0.5mL40%的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因 [ ] A.氢氧化钠不够量
B.硫酸铜不够量
C.乙醛溶液太少
D.加热时间不够一个学生做乙醛的还原性实验时,取1 mol ·L-1 的CuSO4 溶液和0.5 mol ·L-1 的NaOH 溶液各1 mL ,在一支洁净的试管内混合后,向其中又加入0.5 mL 40% 的乙醛,加热至沸腾,结果无红色沉淀出现。 实验失败的原因可能是 [ ] A.未充分加热
B.加入乙醛太多
C.加入NaOH 溶液的量不够
D.加入CuSO4 溶液的量不够A、B、C都是有机化合物,且有如下转化关 系:A  B
B C,A的相对分子质量比B大2,C的相对分子质量比B大16,C能与A反应生成酯(C4H8O2),以下说法正确的是
C,A的相对分子质量比B大2,C的相对分子质量比B大16,C能与A反应生成酯(C4H8O2),以下说法正确的是 [ ] A.A是乙炔,B是乙烯
B.A是乙烯,B是乙烷
C.A是乙醇,B是乙醛
D.A是环己烷,B是苯下列有关实验操作的说法正确的是( ) A.从碘水中萃取碘应该用酒精作萃取剂 B.称量NaOH固体时应在托盘上各放一张大小一样的纸,在纸上称量NaOH C.实验室制乙烯时温度计的水银球应放在烧瓶的出气口位置 D.乙醛的银镜反应实验要用水浴加热而不能用酒精灯直接加热 乙醛和新制的Cu(OH)2反应的实验中,关键的操作是( ) A.Cu(OH)2要过量 B.NaOH溶液要过量 C.CuSO4要过量 D.使溶液pH值小于7 下列说法中正确的是( ) A.凡是能发生银镜反应的物质一定是醛 B.乙醛与新制Cu(OH)2反应,表现酸性 C.在加热和有催化剂的条件下,醇都能被空气中的O2所氧化,生成对应的醛 D.福尔马林是35%~40%的甲醛水溶液,可用于浸制生物标本 某学生做乙醛的还原性实验时,取1mol/L CuSO4溶液和0.5mol/L NaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL 40%的乙醛,结果无红色沉淀出现.导致该实验失败的原因可能是( ) A.未充分加热 B.加入乙醛太少 C.加入NaOH溶液的量不够 D.加入CuSO4溶液的量不够 下列实验的失败原因可能是因为缺少必要的实验步骤造成的是:( )
①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②实验室用无水乙醇和浓硫酸共热到140℃制乙烯
③验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液未出现黄色沉淀
④做醛的还原性实验时,当加入新制的氢氧化铜悬浊液后,未出现红色沉淀.A.①④ B.①③④ C.③④ D.④ 下列有关利用乙醛制备银镜过程的说法不正确的是( )


