pH计算
定义式
根据pH=-lg c(H+),因此计算溶液的pH的关键是计算溶液中H+的浓度。
总体原则
(1)若溶液为酸性,先求C(H+),再求pH;
(2)若溶液为碱性,先求C(OH-),再由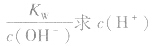 ,最后求pH。
,最后求pH。
单一溶液pH的计算
(1)强酸溶液,如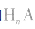 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为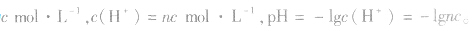
(2)强碱溶液,如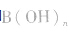 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为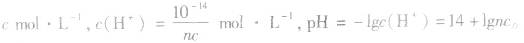
强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即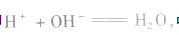 中和后溶液的pH有以下几种情况:
中和后溶液的pH有以下几种情况:
(1)若恰好中和,pH=7。
(2)若剩余酸,先求中和后的c(H+),再求pH。
(3)若剩余碱,先求中和后的c(OH-),再通过KW求出c(H+),最后求pH.
注意:强酸与强碱等体积混合后溶液酸碱性的判断规律:
①若二者pH之和为14,则混合后的溶液呈中性,pH=7
②若二者pH之和大于14,则混合后的溶液呈碱性
③若二者pH之和小于14,则混合后的溶液呈酸性,
溶液稀释后求pH
(1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。
例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7);
pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7):
pH=3的HCl溶液稀释100倍,溶液pH=5;
pH=10的NaOH溶液稀释100倍,溶液pH=8。
注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。
例如:pH=3的 溶液稀释100倍,稀释后
溶液稀释100倍,稀释后
pH=10的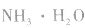 溶液稀释100倍,稀释后
溶液稀释100倍,稀释后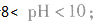
pH=3的酸溶液稀释100倍,稀释后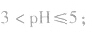
pH=10的碱溶液稀释100倍,稀释后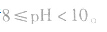
下列叙述正确的是 [ ] A.醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
D.若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11下列叙述正确的是 [ ]
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7下列叙述正确的是 [ ] A.在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
D.若1mL pH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的NaOH溶液中,由水电离出的c(H+)·
c(OH-)= 10-22,则该探究小组在该温度下测得0.01mol/L的NaOH溶液的pH值应为[ ] A.13
B.12
C.11
D.10pH=3的盐酸用水稀释,体积变为原体积的2倍后,这时溶液的pH接近于(已知lg2=0.3、lg3=0.5、lg5=0.7) [ ] A.1.5
B.3.3
C.3.5
D.2.7柠檬是世界上有药用价值的水果之一,对人体十分有益。鲜柠檬维生素含量极为丰富,是美容的天然佳品,能防止和消除皮肤色素沉着,具有美白作用。已知在常温下柠檬水中的c(OH-) =10-11mol/L,则其pH等于 [ ] A.11
B.7
C.5
D.3用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是 [ ] A.4
B.7.2
C.10
D.11.3250 mL pH=12的某一元强碱(MOH)溶液与250 mL 0.025 mol·L-1的硫酸溶液相混合,假设混合后液体体积为500 mL。试求:
(1)混合液的pH;
(2)若原250 mL一元强碱中含溶质0.1 g,则M的相对原子质量为多少?
(3)若给混合液中分别滴入几滴甲基橙、无色酚酞、紫色石蕊试液,则溶液的颜色分别是什么?下列叙述正确的是 [ ] A.某醋酸溶液的PH=a,将此溶液稀释10倍后,溶液的PH=b,则a+1=b
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH<7
C.25℃时,1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0
D.25℃时,若1mL PH=1盐酸与100mL NaOH溶液混合后,溶液PH=7, 则NaOH溶液的PH=11(1)PH=12的氢氧化钠溶液加水稀释100倍,求稀释后的PH
(2)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。某造纸厂排出的废水,经取样分析其中除了含有游离汞.纤维素以及其它的有机物外,其它成分为
c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L,c(Cl-)=1.6×10-5mol/L,c(NO3-)=1.4×10-5mol/L,c(Ca2+)
=1.5×10-5 mol/L,则该废水的pH为__________。(1)25℃时,0.05mol/LH2SO4溶液的pH=________;0.5mol/LBa(OH)2溶液中pH=__________。
(2)在温度T时,某溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,该温度下水的离子积KW=__________;T_______(填<或>或=)25℃。若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中c(OH-)= ____________mol/L;此时溶液中由水电离产生的c(H+)=_________________ mol/L 。有关pH计算结果一定正确的是 [ ] A.强酸pH=a,加水稀释到10n倍,则pH=a+n
B.强酸pH=a,加水稀释到10n倍,则pH<a+n(a+n>7)
C.强碱pH=b,加水稀释到10n倍,则pH=b-n
D.弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n<7)酸雨是过度燃烧煤和石油,生成氮硫的化合物,溶于水生成硫酸和硝酸的缘故。某次雨水分析数据如下:c(SO42-)=2.6×10-5 mol·L-1,c(Cl-)=8.0×10-6 mol·L-1,c(NH4+)=3.0×10-6 mol·L-1,c(Na+)=
1.0×10-6 mol·L-1,c(NO3-)=2.4×10-5 mol·L-1,则此次酸雨的pH接近于(1g8=0.9)[ ] A.6.5
B.5
C.4.1
D.4.8现有温度相同、pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混合后,所得溶液的
pH接近于[ ] A.a-lg2
B.b-lg2
C.a+lg2
D.b+lg2将K2SO4、Al2(SO4)3、KAl(SO4)2三种盐混合,溶解于硫酸酸化的水中,测得c(SO42-)=0.125 mol·L-1,
c(Al3+)=0.065 mol·L-1,c(K+)=0.045 mol·L-1,假设溶液中H2SO4完全电离为H+和SO42-,则溶液的pH为[ ] A.1
B.2
C.3
D.4已知100℃的温度下,水的离子积Kw=1×10-12。本题涉及的溶液,其温度均为100℃。下列说法中正确的是 [ ] A.0.005 mol/L的H2SO4溶液,pH=2
B.0.001 mol/L的NaOH溶液,pH=11
C.0.005 mol/L的H2SO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL(1)某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液的pH为__________。
(2)某溶液中由水电离的c(H+)=10-4mol·L-1,则该溶液的pH为___________。
(3)某溶液的pH为4,则该溶液中由水电离出的c(H+)为__________。
(4)某溶液的pH为10,则该溶液中由水电离出的c(H+)为__________。
在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如上图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),
试计算:
(1)最初混合酸溶液中c(H2SO4)=___________ ,c(HCl)= ____________;
(2)A点pH=____________________ ;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48) ____________________________________________________________________。取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于13,则原溶液的浓度为 [ ]
A.0.01 mol/L
B.0.017 mol/L
C.0.05 mol/L
D.0.50 mol/L某温度下的溶液中,c(H+)=1.0×10X c(OH-)=1.0×10Y。X与Y的关系如下图所示: 
(1)该温度下,中性溶液的pH为____________ ;
(2)该温度下,0.01mol/LNaOH溶液的pH为_____________ ;
(3)该温度下,0.005mol/L硫酸溶液的pH为_____________________ ;
(4)该温度下,pH=4的硫酸溶液与pH=10的NaOH溶液以一定体积混合,混合后恰好反应,则混合前硫酸溶液与NaOH溶液体积比为________________________ 。下列叙述正确的是 [ ] A.某氨水溶液的  ,将此溶液稀释10倍后,溶液的
,将此溶液稀释10倍后,溶液的 ,则b + 1= a
,则b + 1= a
B.在滴有酚酞溶液的氨水里,加入 至溶液恰好无色,则此时溶液的pH = 7
至溶液恰好无色,则此时溶液的pH = 7
C. 醋酸的
醋酸的 ,
, 盐酸的pH小于7且接近7
盐酸的pH小于7且接近7
D.若1mL 的盐酸与100mL
的盐酸与100mL 溶液混合后,溶液
溶液混合后,溶液 的则
的则 溶液的
溶液的
下列叙述正确的是 [ ] A.某醋酸溶液的pH =a,将此溶液稀释1倍后,溶液的pH =b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH <7
C.1.0×10-3 moI/L盐酸的pH= 3.0,1.0×10-8 mol/L盐酸的pH= 8.0
D.若l mL pH =1的盐酸与100 mL NaOH溶液混合后,溶液的pH =7,则NaOH溶液的pH =11下列说法不正确的是 [ ] A.25℃时,pH =1的HNO3和pH =1的CH3COOH等体积混合后所得溶液的pH约为1
B.25℃时,Mg(OH)2悬浊液中由Mg(OH)2电离出的c(OH-)≈10-4mol/L,则Mg(OH)2悬浊液的pH约为10
C.25℃pH =a的NaOH溶液和pH=b的NaOH溶液等体积混合pH为
D.25℃时,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该强碱溶液的pH为10.525℃时,5 mL0.1 mol·L-1 H2SO4和15mL0.1 mol·L-1 NaOH溶液相混合并稀释至500mL,所得溶液的pH为 [ ] A.12.3
B.11
C.3
D.1.725℃时.5 ml 0.1 mol/L H2SO4和15 mL 0.1 mol/L NaOH溶液相混合并稀释至500 mL,所得溶液的pH为 [ ] A. 12.3
B. 11
C. 3
D. 1.7为了测定K2CO3和NaHCO3混合物的组成,某学生称取了2. 22 g混合物溶于水配成0.5 L溶液,向其中加入0.5 L 物质的量浓度为0.06 mol/L的Ba(OH)2溶液,测得沉淀的质量为3.94 g。试求:
(1)混合物中K2CO3和NaHCO3的物质的量之比;
(2)取混合后所得溶液体积的1/10,加水配成500 mL溶液, 所得溶液的pH。某温度下,CO2饱和溶液的浓度是0.03 mol/L,其中1/3的CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离:H2CO3  H++ HCO3-,则溶液的pH约为
H++ HCO3-,则溶液的pH约为[ ]
A.3
B.4
C.5
D.6(1)用热水配制AlCl3溶液,会出现浑浊现象,原因是(用离子方程式和必要的文字说明):_____________________________ 。要消除浑浊现象,又不污染药品,可加入适量的___________溶液。
(2)常温下,有①0. 01mol/LHCl溶液;②pH= 12的氨水,其中水的电离程度①______(填“>”“<”或“=”)②,若将①、②混合后所得溶液pH =7,则消耗溶液的体积:①_____(填“>”“<”或“=”)②。若用①来滴定未知浓度的氨水,通常选用____作指示剂,达滴定终点时各离子浓度由大到小的顺序是_____________________。
(3)某温度(T℃)时,测得0.01 mol/LNaOH溶液的pH= 11,则在该温度下,将100 mL 0.2 mol/L的稀盐酸与 100 mL0.4 mol/L的NaOH溶液混合后,溶液的pH=___________常温时,以下4种溶液pH最大的是 [ ] A.0.01mol/L甲酸溶液
B.0.02mol/L甲酸溶液与0.02mol/L KOH溶液等体积混合后所得的溶液
C.0.03mol/L甲酸溶液与pH=12的NaOH溶液等体积混合后所得的溶液
D.甲酸溶液与NaOH溶液混合,得到c(HCOO-)= c(Na+)的溶液取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 [ ] A.0.01 mol/L
B.0.017 mol/L
C.0.05 mol/L
D.0.50 mol/L在t℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示 
假设溶液混合前后的体积变化忽略不计,则c为 [ ] A.3
B.4
C.5
D.6重水(D2O)在25℃时,Kw=10-12 mol2·L-2,定义pD=-lg[c(D+)],pOD=-lg[c(OD-)], 则下列说法正确的是 [ ] A.25℃时,纯重水中pD=7
B.25℃时,0.1 mol/L NaCl的重水溶液中pD=pOD=7
C.25℃时,1 mol/L的DCl重水溶液pD=0,pOD=12
D.25℃时,0.01 mol/L的NaOD溶液中pOD=10已知稀盐酸的物质的量浓度为a mol/L,稀NaOH溶液的物质的量浓度为b mol/L,当两种溶液等体积混合时,所得溶液的pH=2(混合液体积为原体积的和),则a和b的关系为 [ ] A.a=b/2
B.b=a/2
C.a=b+0.1
D.a=b+0.02在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示。请回答下列问题 
(1)曲线Ⅰ代表的温度下,水的离子积为__________,曲线Ⅰ所代表的温度________(填“高于”、“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是__________________________。
(2)曲线Ⅰ所代表的温度下,0.01 mol/L的NaOH溶液的pH为________。在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则
(1)该温度下水的离子积常数Kw=________。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L。
(3)在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=____。25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH一样的定义来规定其酸碱度:pD=-lg[c(D+)]。
(1)写出重水的电离方程式。
(2)求25℃时,重水中各种离子的物质的量浓度。
(3)求25℃时,重水的pD。(1)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液________mL(假定溶液体积有加和性,下同)。
(2)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=________。
(3)将0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液等体积混合后,该混合溶液的pH=________。
(4)25℃时,10体积pH=a的某强酸与1体积pH=b的某强碱混合后,溶液呈中性,则a和b满足的关系________________。(1)室温时1 L 0.01 mol·L-1的硫酸氢钠溶液的pH为____________,在其中滴入等体积的0.01 mol·L-1的
Ba(OH)2溶液后,加水稀释到10 L,所发生反应的离子方程式为______________, pH为________。
(2)某温度(t℃)时,水的离子积为Kw=1×10-13 mol2·L-2,则该温度(填“大于”、“小于”或“等于”)
________25℃,其理由是________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________。
②若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是________。25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知
Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”)________,其理由是__________________。
(2)a值可否等于5(填“可”或“否”)________,其理由是__________________。
(3)a的取值范围是________。用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是 [ ] A.4
B.7.2
C.10
D.11.3在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则
(1)该温度下水的离子积常数Kw=________。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L。
(3)在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=_____。
- 1下列说法正确的是 ( )A.效率高的机械,功率一定大B.做功时间长的机械,功率一定大C.所有机械的机械效率都小于l
- 2(8分)现有A、B、C、D、E五种钠盐,它们分别是中的某一种。为验证各种物质的具体成分.将固体样品分别配成溶液后进行实验
- 3书面表达(满分25分)假如你是李华,在互联网上看到美国高中生Tony希望结识一位中国朋友的信息,请你用英文给他发一封电子
- 4我国水旱灾害比较频繁的主要原因是 A.地势高低不同B.夏季风进退规律反常C.海陆位置不同D.冬季风强弱不同
- 5列方程解应用题:甲、乙两车同时从A城去B城,甲车每小时行35千米,乙车每小时行40千米,结果乙比甲提前半小时到达B城.问
- 6如图,AB∥CD,O为∠BAC,∠ACD的平分线的交点,OE⊥AC于E,且OE=2,则AB与CD间的距离为( )A.2
- 7母亲是伟大的,母亲在***期间,要为胎儿提供营养物质和氧,排出胎儿产生的二氧化碳等废物。母亲和胎儿之间进行物质交换的器官是
- 8【题文】已知集合M={x
- 9矩形ABCD的对角线交于点O,过点A作AE∥BD交CB的延长线于点E,若∠BOC=60 °,,则△ACE的周长为(
- 10下列离子方程式书写正确的是A.钠跟水反应:Na+2H2O=Na++2OH-+H2↑B.硫酸铜溶液与氢氧化钡溶液反应:SO
- 1“人肉搜索”在2008中国网事中绝对是一个热词。在汶川地震中,人肉搜索帮助许多人,找到了亲人;但是也发生了某大学学生因被
- 2大学毕业生张某想到某中学应聘,该校校长曾是张某父亲的学生,张某写了一封求职信给校长,其中有三处不当,请加以修改(6分)欣
- 3请阅读下列应用文及相关信息,并按照要求匹配信息。请将答案涂在答题卡上对应题号的位置。A.Judged the Car o
- 4观察漫画,回答1—2题1、漫画中儿子拿出的这部法律可能是[ ]A、中华人民共和国预防未成年人犯罪法B、婚姻法C、
- 5我国在上世纪80年代引入了美国人发明的个人所得税。据此回答19—20题:小题1:我国之所以引进个人所得税,是因为个人所得
- 6有关城市化过程对自然地理环境的影响,叙述正确的是 ①产生城市热岛效应
- 7当前,我国进行的改革,从实质上看( ) A.是社会主义制度的自我完善和发展B.改变社会主义性质C.社会主义经济制
- 8Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的
- 9什么是新文学?文学革命与我们今天的语文学习有什么关系?_________________________________
- 10完形填空。 I ran across an old photo of him the other day, thi

 。两种溶液等体积混合后,所得溶液的pH接近于
。两种溶液等体积混合后,所得溶液的pH接近于 


