原子核外核外电子排布与表示
原子核外电子的排布
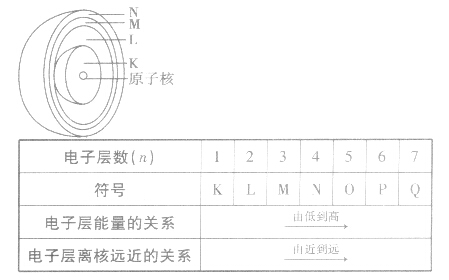
在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
电子层
电子层在含有多个电子的原子里,电子分别存能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5.6,7或K、L、 M、N、O、P、Q来表示从内到外的电子层
原子结构与元素的性质
原子的核外电子排布对元素的化学性质有着非常重要的影响。元素的化学性质主要取决于原子的核外最外层电子数。
1.元素的金属性、非金属性(得失电子能力)与最外层电子数的关系
(1)稀有气体元素原子最外层电子数为8(He为 2),已达稳定结构,既不易失电子也小易得电子,所以化学性质不活泼。
(2)金属元素原子最外层电子数一般小于4,较易失去电子而达到稳定结构,其单质表现还原性。
(3)非金属元素原子最外层电子数一般大于或等于4,较易获得电子而达到稳定结构,其单质多表现氧化性。
2.元素的化合价与原子最外层电子数的关系
元素显正价还是显负价及其数值大小与原子的最外层电子数密切相关。其一般规律可归纳如下表:

核外电子排布的一般规律
(1)原子核外各电子层最多容纳2n2个电子.
(2)原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
(3)次外层电子数目不超过18个(K层为次外层时不超过2个,L层为次外层时不超过8个)。倒数第三层电子数目不超过32个。
(4)核外电子分层排布,电子总是优先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即最先排K层,当K层排满后,冉排L层等。原子核外电子排布不是孤立的,而是相互联系的。层数相同而位置不同的电子层中最多容纳的电子数小一定相同,如N层为最外层时,最多只能排8个电子;N层为次外层时,最多只能排18个电子而不是32个电子(2×42=32)。
下列原子核外电子排布中,违背“泡利不相容原理”的是_________;违背“洪特规则”的是_______;违背“洪特 规则特例”的是___________。违背“能量最低原理”的是________;(填编号)
①6C轨道表示式为 ②7N轨道表示式为:
②7N轨道表示式为:
③26Fe2+电子排布式为:1s22s22p63s23p63d44d2 ④29Cu电子排布式为:1s22s22p63s23p63d94s2
⑤20Ca电子排布式为:1s22s22p63s23p63d2 ⑥15P电子排布式为:1s22s22p63s23p3在基态多电子原子中,关于核外电子能量的叙述错误的是 [ ]
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低在基态多电子原子中,关于核外电子能量的叙述错误的是 [ ]
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低关于原子轨道的说法正确的是 [ ] A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合形成
C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组新轨道
D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键在氯化氢分子中,形成共价键的原子轨道是 [ ] A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道以下对核外电子运动状况的描述正确的是 [ ] A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同下列有关核外电子运动规律的描述中,错误的是 [ ] A.核外电子质量很小,在原子核外做高速运动
B.在电子云示意图中,小黑点密表示电子在核外空间单位体积内出现的几率大
C.在电子云示意图中,通常用小黑点来表示电子绕核做高速圆周运动
D.s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃形的下列关于氢原子电子云图的说法正确的是 [ ] A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述图1和图2分别是电子云图、原子轨道图,则有关的说法中正确的是 
[ ] A.电子云图就是原子轨道图
B.3p2表示3p能级中有两个轨道
C.由图2可知s轨道呈圆形,有无数条对称轴
D.p能级最多可排6个电子下列关于1s电子在原子核外出现的概率分布图,也称电子云示意图(如图所示)的有关说法中,正确的是 
[ ] A.通常用小黑点来表示电子的多少,黑点密度大,电子数目多
B.黑点密度大,单位体积内电子出现的机会大
C.氢原子核外电子绕核做高速圆周运动
D.氢原子的电子云图就是氢原子的ls原子轨道为解释原子光谱是线状光谱这一事实,玻尔提出了核外电子的分层排布理论,下列说法中,不符合这一理论的是 [ ] A.电子绕核运动具有特定的半径和能量
B.电子在特定半径的轨道上运动时不辐射能量
C.电子跃迁时,会吸收或放出特定的能量
D.提示了氢原子光谱存在多条谱线图甲和图乙分别是1s电子的概率分布图和原子轨道图。下列有关认识正确的是 
[ ] A.图甲中的每个小黑点表示1个电子
B.图乙表示1s电子只能在球体内出现
C.图乙表明1s轨道呈圆形,有无数对称轴
D.图甲中的小黑点表示某一时刻,电子在核外所处的位置下列有关电子云和原子轨道的说法正确的是 [ ] A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D.与s电子原子轨道一样,p电子原子轨道的平均半径也随能层的增大而增大下面是s能级p能级的原子轨道图,试回答问题 
(1)s电子的原子轨道呈____形,每个s能级有________个原子轨道;p电子的原子轨道呈________形,每个p能级有____个原子轨道。
(2)s电子原子轨道、p电子原子轨道的半径与什么因素有关?是什么关系?
_________________________________原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满状态,且核外的未成对电子只有一个。回答下列问题:
(1)X能形成多种常见单质,其熔点最低的单质为___晶体;在熔点最高的两种单质中,X的杂化方式分别为 ____、____。
(2)X、Y分别与氢元素形成的化学键的极性大小为X-H____Y-H,键能大小为X-H____Y-H(填“<”、 “>”或“=”)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有 I3、I4、I5…,推测Z元素的电离能突增应出现在第___电离能。
(4)W原子的电子排布式为___;W基态原子有___种不同形状的原子轨道;W晶体的配位数为____;下图___表示的是W晶体中原子的堆积方式(填“甲”、“乙”或“丙”)。
(5)向W的硫酸盐溶液中逐滴滴加氨水至过量,最终形成的化合物中含___键(填化学键 类型)。 下列关于多电子原子核外电子的运动规律的叙述中正确的是 [ ] A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量低的电子在离核近的区域绕核旋转下列关于电子云的叙述中不正确的是 [ ] A.电子云是用小黑点的疏密程度来表示电子在空间出现概率大小的图形
B.电子云实际是电子运动形成的类似云一样的图形
C.点密集的地方电子出现的概率大
D.轨道不同,电子云的形状也不一样下列关于氢原子电子云图的说法中正确的是 [ ] A.黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的概率大
C.电子云图是对电子运动无规律性的描述
D.电子云图描述了电子运动的客观规律下列说法中正确的是 [ ] A.玻尔的原子轨道模型可以解释大多数原子的线状光谱的形成原因
B.线状光谱特征谱线对应的光的频率与原子中能级之间的能量差可表示为 hv=Ej-Ei
C.氢原子的1s电子云是平面圆形,其中的每一个小黑点代表一个电子
D.在s轨道上运动的所有电子的能量是相同的下列说法中正确的是 [ ] A.因为p轨道是“8”字形的,所以p电子走“8”字形
B.在M层中,有3s、3p、3d、3f四个轨道
C.氢原子光谱是线状光谱
D.原子轨道与电子云都是用来形象描述电子运动状态的(1)原子轨道:把电子出现的概率约为________的空间圈出来,所得到的电子云轮廓图形称为原子轨道。
(2)量子力学研究表明,处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,轨道类型不同,轨道的形状也不同。用小写的英文字母s、p.d、f分别表示不同形状的轨道,s轨道呈形________,p轨道呈形________,d轨道和f轨道比较复杂。
(3)s能级只有____个轨道,p能级有____个轨道,d能级有______个轨道,f能级有7个轨道。下列说法中不正确的是 [ ] A.原子半径实际上是核外电子运动“区域”的半径
B.原子半径的数值大小是对多个原子半径测量的平均数值
C.化合物中两原子的核间距等于两个原子半径之和
D.稀有气体元素的原子半径比相邻的非金属元素的原子半径小下列关于电子云的叙述中不正确的是 [ ] A.电子云是用小黑点的疏密程度来表示电子在空间出现概率大小的图形
B.电子云实际上是电子运动形成的类似云一样的图形
C.电子云图说明离核越近,电子出现概率越大;离核越远,电子出现概率越小
D.轨道不同,电子云的形状也不一样用“>”“<”或“=”表示下列各组多电子原子的原子轨道能量的高低。
(1)2s____3p;
(2)4px_____4pz;
(3)4s____4d;
(4)4s____3p;
(5)5p____7d;
(6)3d____4d。P轨道电子云形状正确的是( ) A.球形对称 B.圆形对称 C.极大值在x、y、z轴上的纺锤形 D.互相垂直的花瓣形 下列有关“核外电子的运动状态”的说法,错误的是( ) A.各原子轨道的伸展方向按p、d、f的顺序分别为3、5、7 B.核外电子云表示电子在核外单位体积的空间出现的机会多少 C.原子轨道伸展方向与能量大小是无关的 D.原子核外可能有两个电子的运动状态是完全相同的 下面关于多电子原子核外电子的运动规律的叙述正确的是( ) A.核外电子是分层运动的 B.所有电子在同一区域里运动 C.能量高的电子在离核近的区域运动 D.能量高的电子在离核近的区域绕核旋转 关于多电子原子的核外电子的运动说法正确的是( ) A.原子核外电子的能量没有差别,原子的运动也是杂乱无章的 B.原子核外电子的能量是不同的,能量低的在离核近的位置运动 C.原子核外电子的能量是不同的,能量高的在离核近的位置运动 D.原子核外电子的能量是不同的,能量低的、能量高的都有可能在离核近的位置运动 简单原子的原子结构可用如图表示方法形象表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述错误的是( ) A.①②③属同种元素 B.①②③互为同位素 C.①②③为碳元素的三种核素 D.①②③是三种化学性质不同的粒子 
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( ) A.:He B. 
C.1s2 D. 
下列关于氢原子电子云图的说法正确的是( ) A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大 B.黑点密度大,单位体积内电子出现的机会大 C.通常用小黑点来表示电子绕核作高速圆周运动 D.电子云图是对运动无规律性的描述 以下对核外电子运动状况的描述正确的是( ) A.同一原子中,2p,3p,4p能级的轨道依次增多 B.当碳原子的核外电子排布由 
转变为
时,这一过程中释放能量C.3p2表示3p能级有两个轨道 D.在同一能级上运动的电子,其运动状态可能相同 下列叙述中,正确的是( ) A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 D.如果某一基态3p能级上仅有2个电子,它们自旋方向必然相反 以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )








