百科
离子方程式的书写及正误判断
定义
用实际参加反应的离子符号表示离子反应的式子。
书写规则
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
书写及正误的判断方法
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“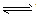 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。
强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“ ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
相关试题
暂时还没有查询到你想要的内容!
最新试题
- 1分解因式:﹣x3+4x2y=( )
- 2下面是某同学制作和观察人体口腔上皮细胞临时装片的部分操作步骤,其中操作错误的是( )A.在洁净的载玻片中央滴一滴生理盐
- 3如图,点是菱形的对角线上一点,连接并延长,交于,交的延长线于点.(1)图中△与哪个三角形全等?并说明理由.(2)求证:△
- 4第一次世界大战爆发的原因有哪些?根本上原因是什么?___________________________________
- 5提出人类和类人猿有共同祖先的科学家是: [ ]A.达芬奇 B.达尔文 C.袁隆平D.哈维
- 6若f(x)是定义在(0,+∞)上的增函数,且对一切正实数x,y,满足。 (1)求f(1)的值; (2)若f(6)=1,解
- 72009年10月,中国散货轮“德新海”号在印度洋塞舌尔群岛遭遇索马里海盗袭击,有人研究发现这一地区在15世纪末也曾出现过
- 8如右图所示,水在壶中被加热,又从凉铁板上掉下的水是蒸馏水在获得蒸馏水的过程中,水经历的物态变化是 ( )A.先升华
- 9设a,b∈R,a2+2b2=6,则a+b的最小值是( )A.-22B.-533C.-3D.-72
- 10若Sn表示等比数列{an}的前n项和,公比不为-1,Sn=48,S2n=60,则S3n=______.
热门考点
- 1下列关于《格列佛游记》的叙述不正确的一项是(2分)A.《格列佛游记》讲述了英国船医格列佛因海难等原因分别流落到小人国、大
- 2下列语句中划线的成语使用正确的一项是( )(2分)A.两个阔别多年的老友意外地在一条小巷里狭路相逢;两人又是握手又是
- 3下列各组混合物中,分别加入蒸馏水,充分搅拌后有红褐色沉淀生成的是( )A.硫酸钠和氢氧化钠B.氯化铜和氢氧化钠C.氯化
- 4阅读下面材料,在空白处填入适当的内容(不超过3个单词)或括号内单词的正确形式One day, Nick invited
- 5椭圆与直线交于A、B两点,过原点与线段AB中点的直线的斜率为的值为_____________
- 6流域内矿产资源的蕴藏状况也会影响流域综合开发的方向,下列不属于田纳西河流域内丰富矿产资源的是( )A.煤炭B.铁矿C.
- 7如图所示,在正方形ABCD中,延长BC 至E ,使CE=CA,连结AE,则∠CAE=( )度。
- 8、圆x2+y2-4x+6y+9=0的点,其中到直线x-y+2=0的最远距离是
- 9—Watch!—I ____ but ____ I ____ anything unusual.watched; hav
- 10发展和建立高新技术产业最重要的条件是A.优越的地理位置B.丰富的自然资源C.雄厚的科技力量D.充足的劳动力资源
